
Mục lục
I. Phản nghịch ứng tất cả sự đổi khác số oxi hóa với phản ứng không tồn tại sự đổi khác số oxi hóa
1. Làm phản ứng hóa hợp
2. Bội phản ứng phân hủy
3. Phản bội ứng thế
4. Bội nghịch ứng trao đổi
II, phản nghịch ứng thu nhiệt và phản ứng tỏa nhiệt
I. Bội nghịch ứng có sự chuyển đổi số oxi hóa với phản ứng không tồn tại sự biến hóa số oxi hóa
1. Phản bội ứng hóa hợpPhản ứng hóa hợp chưa hẳn là bội nghịch ứng oxi hóa – khử, số lão hóa của tất cả các nhân tố trong phản ứng không nắm đổi.
Bạn đang xem: Phân loại phản ứng trong hóa học vô cơ
Ví dụ về phản ứng của hidro cùng oxi:
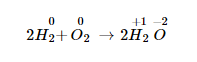
Số oxi hóa của hidro tăng tử 0 lên +1. Số oxi hóa của oxi giảm từ 0 xuống -2.
Ví dụ 2:
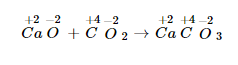
Số oxi hóa của các nguyên tố trong phản nghịch ứng hóa học không thay đổi.
=> Trong làm phản ứng hóa hợp, số oxi hóa của những nguyên tốt có thể biến đổi hoặc không, chính vì vậy, phản nghịch ứng hóa hợp rất có thể là làm phản ứng thoái hóa – khử hoặc không.
2. Phản bội ứng phân hủyPhản ứng phân hủy, số oxi hóa của những nguyên tố tất cả thể biến đổi hoặc không, bởi vì vậy, phản nghịch ứng phân hủy có thể là phản bội ứng thoái hóa – khử hoặc không.
Ví dụ về bội nghịch ứng phân hủy:
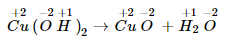
Số oxi hóa của toàn bộ các yếu tắc không nuốm đổi.
Ví dụ 2:
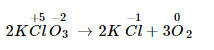
Số lão hóa của oxi tăng trường đoản cú -2 lên 0. Số thoái hóa của clo sút từ +5 xuống -1.
3. Bội nghịch ứng thếPhản ứng vậy là phản ứng tất cả sự biến hóa số oxi hóa của những nguyên tố, các phản ứng vắt là làm phản ứng thoái hóa khử.
Ví dụ:
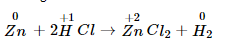
Số lão hóa của kẽm tăng từ 0 lên +2. Số oxi hóa của hidro bớt tử +1 xuống 0.
4. Bội nghịch ứng trao đổiPhản ứng thảo luận là phản nghịch ứng lúc số oxi hóa của những nguyên tố không núm đổi. Bội nghịch ứng trao đổi chưa phải là bội phản ứng lão hóa – khử.
Ví dụ:
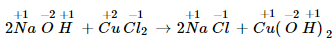
Số oxi hóa của những nguyên tố trong phản nghịch ứng trên rất nhiều không đổi khác => không phải là phản nghịch ứng oxi hóa khử.
Kết luận
Ta có thể chia những phản ứng chất hóa học thành 2 loại:
Phản ứng hóa học gồm sự thay đổi số oxi hóa (phản ứng oxi hóa – khử): bội phản ứng thế, một trong những phản ứng hóa đúng theo và một số phản ứng phân diệt thuộc một số loại phản ứng chất hóa học này.Phản ứng hóa học không tồn tại sự chuyển đổi số oxi hóa (phản ứng không phải phản ứng lão hóa – khử): bội nghịch ứng trao đổi, một trong những phản ứng hóa hợp, một trong những phản ứng phân hủy thuộc các loại phản ứng này.II, phản ứng thu nhiệt và phản ứng tỏa nhiệt
Phản ứng thu sức nóng là phản nghịch ứng chất hóa học hấp thụ tích điện dưới dạng sức nóng (sản xuất vôi…)
Phản ứng tỏa nhiệt là làm phản ứng hóa học giải phóng năng lượng dưới dạng nhiệt (phản ứng đốt cháy xăng dầu, hỗ trợ năng lượng để vận hành xe cộ…)
Phương trình nhiệt độ hóa họcNgười ta cần sử dụng ΔH (nhiệt phản nghịch ứng) là đại lượng dùng làm chỉ lượng nhiệt tất nhiên mỗi phản nghịch ứng hóa học.
ΔH có mức giá trị âm vày phản ứng tỏa nhiệt độ làm những chất phản bội ứng mất giảm năng lượng. Đối với làm phản ứng thu nhiệt, ΔH có giá trị dương vì những chất phản nghịch ứng đề xuất lấy thêm năng lượng.
Các phương trình bội phản ứng gồm ghi thêm giá bán trị ΔH cùng trạng thái của các chất được hotline là phương trình sức nóng hóa học, ví dụ:
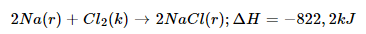
ΔH=−822,2k
J">ΔH=−822,2k
J có nghĩa là khi tạo nên 2">22 mol Na
Cl">Na
Cltừ kim loại Na">Na và khí Cl2">Cl2 phản ứng thoát ra 822,2k
J">822,2k
J.

PHẢN ỨNG CÓ SỰ cụ ĐỔI SỐ OXI HÓA VÀ PHẢN ỨNG KHÔNG CÓ SỰ cầm ĐỔI SỐ OXI HÓA
PHẢN ỨNG CÓ SỰ rứa ĐỔI SỐ OXI HÓA VÀ PHẢN ỨNG KHÔNG CÓ SỰ chũm ĐỔI SỐ OXI HÓA 1. Phản bội ứng hóa hợp a) tỉ dụ Thí dụ 1:
Ca+2O−2+C+4O−22→Ca+2C+4O−23Ca+2O−2+C+4O−22→Ca+2C+4O−23
Số oxi hóa của tất cả các thành phần không nắm đổi.
Đây chưa hẳn là phản nghịch ứng thoái hóa - khử.
b) nhận xét
Trong bội phản ứng hóa hợp, số oxi hóa của những nguyên tố tất cả thể thay đổi hoặc không nạm đổi. Như vậy, phản nghịch ứng hóa hợp rất có thể là phản bội ứng oxi hóa - khử hoặc không hẳn là bội phản ứng thoái hóa - khử.
2. Phản bội ứng phân hủy
a) Thí dụ
Thí dụ 1:
Số oxi hoá của oxi tăng từ −2−2 lên 00;
Số lão hóa của clo sút từ +5+5 xuống −1−1.
Đây là phản bội ứng oxi hóa - khử.
Thí dụ 2: Cu+2(O−2H+1)2→Cu+2O−2+H2+1O−2Cu+2(O−2H+1)2→Cu+2O−2+H2+1O−2
Số oxi hóa của tất cả các nhân tố không vậy đổi.
Đây không phải là phản nghịch ứng oxi hóa - khử.
Xem thêm: Gợi Ý Những Trang Web Luyện Thi Toeic Cấp Tốc Online Miễn Phí Cực Hiệu
b) nhấn xét
Trong bội phản ứng phân hủy, số thoái hóa cuả những nguyên tố bao gồm thể biến hóa hoặc không cố đổi. Như vậy, phản nghịch ứng phân hủy rất có thể là bội nghịch ứng thoái hóa - khử hoặc không phải là bội nghịch ứng lão hóa - khử.
3. Bội nghịch ứng thế
a) Thí dụ
Thí dụ 1: Cu0+2Ag+1NO3→Cu+2(NO3)2+2Ag0Cu0+2Ag+1NO3→Cu+2(NO3)2+2Ag0
Số thoái hóa của đồng tăng từ 00 lên +2+2;
Số oxi hóa của bội nghĩa giảm từ +1+1 xuống 00.
Đây là phản bội ứng oxi hóa - khử.
Thí dụ 2: Zn0+2H+1Cl→Zn+2Cl2+H20Zn0+2H+1Cl→Zn+2Cl2+H20
Số lão hóa của kẽm tăng từ 00 lên +2+2;
Số thoái hóa của hiđro sút từ +1+1 xuống 00.
Đây là bội phản ứng lão hóa - khử.
b) nhấn xét
Trong phản ứng thế, khi nào cũng tất cả sự biến đổi số oxi hóa của những nguyên tố. Các phản ứng thế là đều phản ứng lão hóa - khử.
4. Làm phản ứng trao đổi
a) Thí dụ
Thí dụ 1: Ag+1N+5O−23+Na+1Cl−1→Ag+1Cl−1+Na+1N+5O−23Ag+1N+5O−23+Na+1Cl−1→Ag+1Cl−1+Na+1N+5O−23
Số oxi hóa của toàn bộ các yếu tố không gắng đổi.
Đây chưa phải là phản ứng oxi hóa - khử.
Thí dụ 2: 2Na+1O−2H+1+Cu+2Cl2−1→2Na+1Cl−1+Cu(+1O−2H)+122Na+1O−2H+1+Cu+2Cl2−1→2Na+1Cl−1+Cu(+1O−2H)+12
Số oxi hóa của toàn bộ các yếu tố không cầm cố đổi.
Đây chưa phải là phản nghịch ứng lão hóa - khử.
b) thừa nhận xét
Trong bội phản ứng trao đổi, số oxi hóa của các nguyên tố không ráng đổi. Những phản ứng trao đổi chưa phải là bội nghịch ứng lão hóa - khử.
5. Kết luận
Dựa vào sự thay đổi số oxi hóa, có thể chia bội nghịch ứng chất hóa học thành nhì loại:
- Phản ứng hóa học gồm sự biến đổi số lão hóa (phản ứng thoái hóa - khử).
Phản ứng thế, một số phản ứng hóa vừa lòng và một trong những phản ứng phân hủy thuộc loại phản ứng chất hóa học này.
- Phản ứng hóa học không có sự chuyển đổi số thoái hóa (phản ứng không hẳn oxi hóa - khử).
Phản ứng trao đổi, một vài phản ứng hóa hợp và một số trong những phản ứng phân hủy thuộc một số loại phản ứng hóa học này.
II - PHẢN ỨNG THU NHIỆT VÀ PHẢN ỨNG TỎA NHIỆT
Các biến hóa hóa học đều phải có kèm theo sự lan ra hay dung nạp năng lượng. Năng lượng kèm theo phản ứng hóa học thường xuyên ở dạng nhiệt.
1. Định nghĩa
Phản ứng tỏa nhệt là phản ứng hóa học giải phóng tích điện dưới dạng nhiệt.
Thí dụ: bội phản ứng đốt cháy xăng dầu, cung ứng năng lượng để quản lý và vận hành xe cộ, sản phẩm công nghệ móc,...
Phản ứng thu sức nóng là phản bội ứng chất hóa học hấp thụ năng lượng dưới dạng nhiệt.
Thí dụ: Khi phân phối vôi, fan ta phải liên tục cung cấp năng lượng bên dưới dạng sức nóng để thực hiện phản ứng phân bỏ đá vôi.
2. Phương trình nhiệt hóa học
Để chỉ lượng nhiệt tất nhiên mỗi làm phản ứng hóa học, fan ta sử dụng đại lượng nhiệt bội phản ứng, kí hiệu là ΔHΔH .
Phản ứng tỏa nhiệt độ thì các chất làm phản ứng nên mất sút năng lượng, chính vì như vậy ΔHΔH có giá trị âm (ΔH















