Trong Hoá Học, bảng tuần trả nguyên tố hoá học là vật cấp thiết thiếu đối với mọi học sinh. Tuy nhiên, không phải người nào cũng hiểu rõ về bảng này và biết phương pháp sử dụng như vậy nào. Đừng lo vì nội dung bài viết dưới đây chúng tôi sẽ hỗ trợ cho chúng ta tất cả rất nhiều thông tin cần thiết nhất.
Bảng tuần hoàn nguyên tố hóa học là gì?
Bảng tuần trả nguyên tố hóa học là gì?
Cấu sinh sản bảng tuần hoàn các nguyên tố hoá học
Ô nguyên tố
Chu kỳ
Nhóm nguyên tố
Có bao nhiêu nguyên tố vào bảng tuần hoàn
Bảng tuần hoàn các nguyên tố hóa học được sắp xếp theo hiệ tượng nào
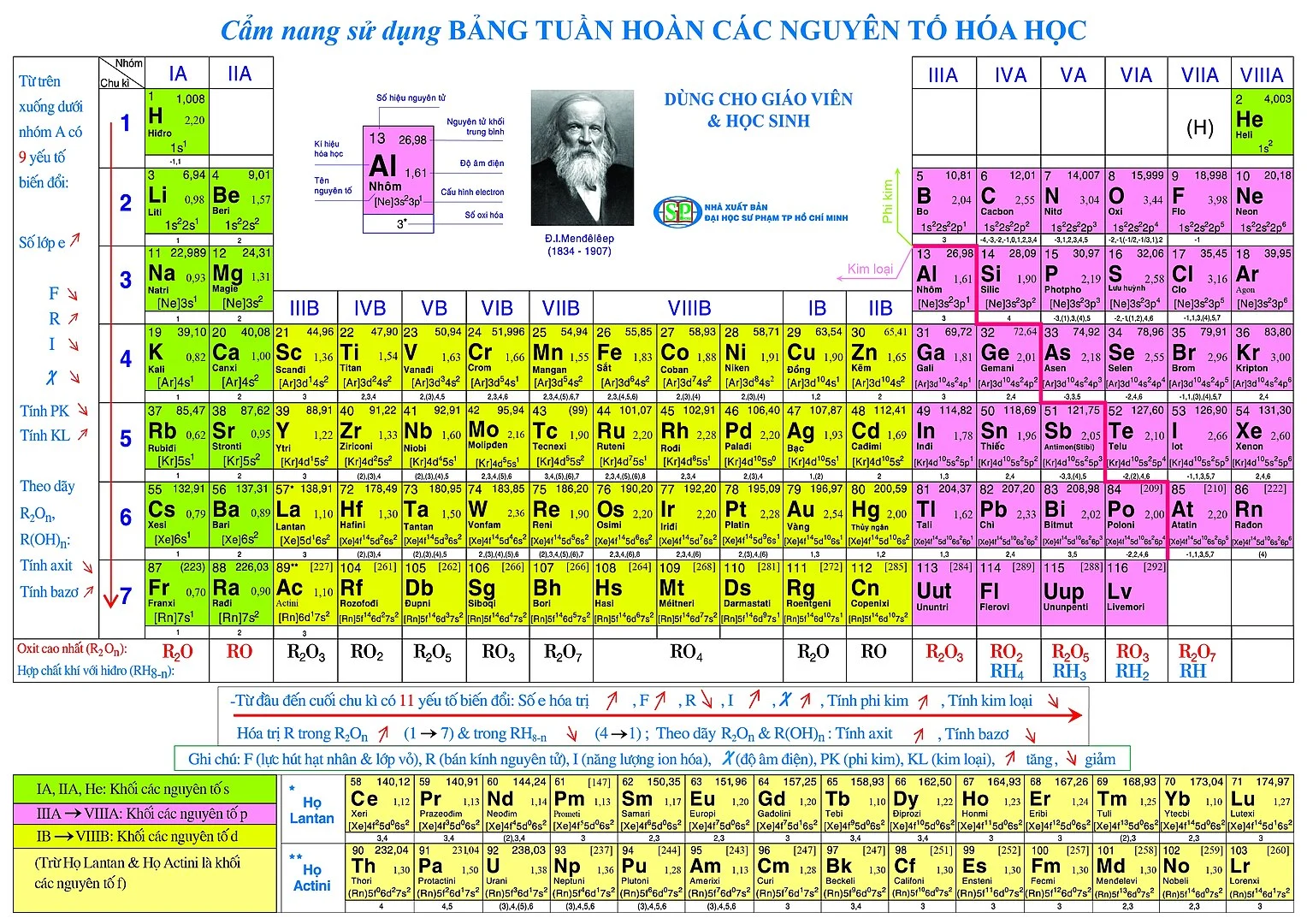
Cách coi bảng tuần trả hóa học
Số nguyên tử
Nguyên tử khối trung bình
Độ âm điện
Cấu hình electron
Số oxi hoá
Tên nguyên tố
Ký hiệu hoá học
Hướng dẫn học tập thuộc bảng tuần hoàn Học theo phương pháp truyền thống
Mẹo học thuộc bảng tuần hoàn
Bảng tuần hoàn các nguyên tố chất hóa học tiếng Anh
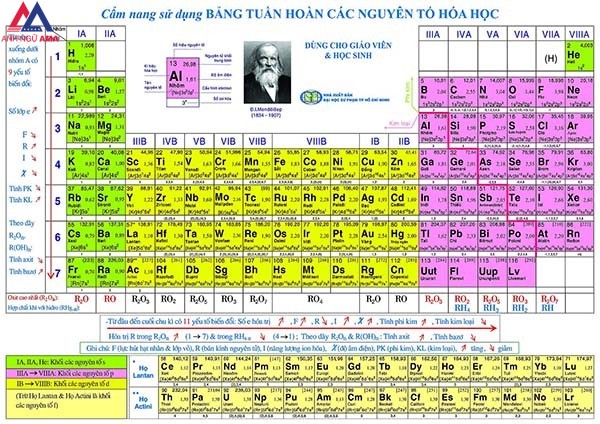
Bảng tuần hoàn những nguyên tố hoá học tập còn mang tên gọi khác là bảng tuần trả Mendeleev. Bảng này thể hiện các nguyên tố hoá học dựa theo cách bố trí số hiệu nguyên tử của chúng.
Bạn đang xem: Bảng hệ thống tuân hoàn
Nó được Dimitri Mendeleev sáng tạo và sử dụng rộng rãi vào năm 1869. Sau đó, bảng này được ứng dụng trong số công trình nghiên cứu khoa học. Nhờ vào nó, nhỏ người có thể dễ dàng gọi về sự quản lý và vận hành của các nguyên tố và các quy phương tiện hoá học tập khác. So với thời gian mới ra mắt, bảng tuần trả hoá học vẫn được bổ sung cập nhật thêm một vài nguyên tố mới.
(adsbygoogle = window.adsbygoogle || <>).push();
Good morning from Vietnam ?? #vietn...
Please enable Java
Script
Good morning from Vietnam ?? #vietnam #live #travelfamily
Cấu sinh sản bảng tuần hoàn các nguyên tố hoá học
Ô nguyên tố
Ô nguyên tố tin báo gồm: cam kết hiệu hoá học, tên nguyên tố, số hiệu nguyên tử, nguyên tử khối của thành phần đó.
Trong đó, số hiệu nguyên tử tất cả số trị bằng số đơn vị điện tích phân tử nhân và thông qua số E vào nguyên tử. Số hiệu nguyên tử đồng thời chính là số sản phẩm công nghệ tự của nguyên tố kia trong bảng tuần hoàn. Ví dụ: Số hiệu nguyên tử của Al là 13 mang lại biết: Al sinh sống ô số 13, năng lượng điện hạt nhân nguyên tử là 13+, có 13 electron vào nguyên tử Nhôm
Chu kỳ
Chu kỳ là một dãy những nguyên tố nhưng nguyên tử của chúng bao gồm cùng số lớp electron cùng được xếp theo sản phẩm công nghệ tự năng lượng điện hạt nhân tăng dần. Thông thường, chu kỳ có số sản phẩm công nghệ tự bằng số lớp electron.
Bảng tuần hoàn hoá học gồm 7 chu kỳ, trong đó, những chu kỳ nhỏ dại là chu kỳ luân hồi số 1,2,3, còn lại là các chu kỳ lớn.
Chu kỳ 1: tất cả 2 nguyên tố có H với HeChu kỳ 2: có 8 yếu tắc Li, Be, B, C, N, O, F, Ne
Chu kỳ 3: có 8 nguyên tố Na, Mg, Al, Si, P, S, Cl, Ar
Chu kỳ 4 và chu kỳ 5: Mỗi chu kỳ có 18 nguyên tố, ban đầu là một sắt kẽm kim loại kiềm và chấm dứt là một khí hiếm
Chu kỳ 6: bao gồm 32 nguyên tố, tự Cs mang đến Rn
Chu kỳ 7: chưa hoàn thiện
Nhóm nguyên tố
Nhóm yếu tắc gồm các nguyên tố mà trong số ấy nguyên tử của chúng bao gồm cùng số electron phần ngoài cùng. Chúng tất cả tính chất tựa như nhau với được xếp theo thứ tự theo chiều tăng của năng lượng điện hạt nhân. Số thiết bị tự của group nguyên tố được xem bằng số electron phần ngoài cùng của nguyên tử.Có 2 các loại nhóm thành phần là team A với nhóm B. Vào đó:Nhóm A: Gồm các nguyên số s cùng p
Nhóm B: Gồm những nguyên tố d và f
Có bao nhiêu nguyên tố vào bảng tuần hoàn
Tính đến thời gian hiện tại, tổng số có 118 yếu tố trong bảng tuần trả được xác thực, bao hàm từ yếu tắc 1 (Hydro) cho tới 118 (Oganesson).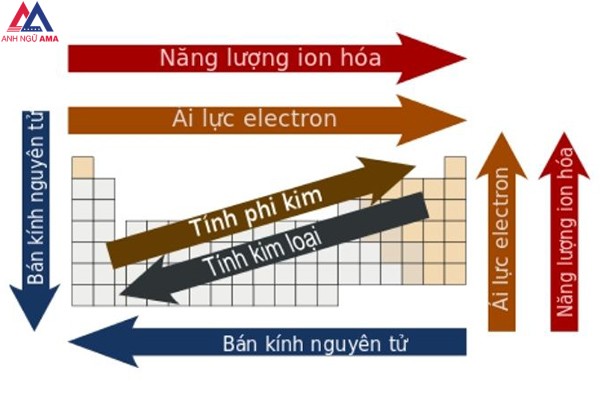
Trong tổng cộng 118 thành phần của thì tất cả đến 98 nguyên tố xuất hiện thêm trong từ nhiên, đôi mươi nguyên tố còn sót lại từ Ensteini mang lại Oganesson thường xuyên chỉ mở ra ở các phép tổng phù hợp nhân tạo. Trong những 98 nguyên tố mở ra trong thoải mái và tự nhiên thì gồm 84 thành phần nguyên thuỷ – tức là chúng đã được xuất hiện trước khi Trái khu đất được hình thành. 14 nguyên tố sót lại chỉ lộ diện trong các chuỗi phân rã của những nguyên tố nguyên thuỷ đó. Ở dạng tinh khiết, không nguyên tố nào nặng hơn Einsteini (99).
Bảng tuần hoàn những nguyên tố hóa học được sắp xếp theo chính sách nào
Các yếu tắc trong bảng tuần hoàn hóa học được thu xếp dựa trên những nguyên tắc sau:Nguyên tắc 1: những nguyên tố hóa học.i.được thu xếp theo chiều tăng dần.i.của điện tích hạt nhân
Nguyên tắc 2: những nguyên tố có cùng số lớp.i.electron trong nguyên tử được xếp vào và một hàng ngang (hay còn được gọi là chu kì)Nguyên tắc 3: những nguyên tố hóa học gồm cùng số electron hóa trị được xếp vào thành một cột (hay còn được gọi là nhóm)Electron hóa trị là hầu hết electron có công dụng tham gia hình thành link hóa học hay còn được gọi là electron lớp bên ngoài cùng.
Cách coi bảng tuần trả hóa học
Số nguyên tử
Số nguyên tử hay còn được gọi là số proton của một yếu tắc hoá học. Số proton này được search thấy trong hạt nhân của nguyên tử đó, giúp khẳng định nguyên tố hoá học tập đó. Số nguyên tử ngay số E vào một nguyên tử trung hoà về điện.Nguyên tử khối trung bình
Đa phần những nguyên tố hoá học hồ hết là láo hợp của khá nhiều đồng vị với tỷ lệ tỷ lệ số nguyên tử khẳng định khác nhau. Vì chưng vậy yêu cầu nguyên tử khối của các nguyên tố có tương đối nhiều đồng vị thường xuyên là vừa đủ khối của các đồng vị bao gồm tính mang đến tỷ lệ phần trăm số nguyên tử tương ứng.
Độ âm điện
Độ âm điện là kĩ năng hút electron của một nguyên tử trong các liên kết hoá học. Độ âm điện của nguyên tử thành phần càng nhỏ thì tính phi kim càng yếu và ngược lại.
Cấu hình electron
Cấu hình electron của nguyên tử cho thấy sự phân bố những electron trong nguyên tử kia ở những trạng thái năng lượng không giống nhau ở sống vùng hiện diện của chúng.Số oxi hoá
Số oxi hoá là số của một nguyên tử hoặc một đội nguyên tử, cho biết số electron trao đổi khi một chất bị khử hoặc bị oxi hoá vào một phân tử.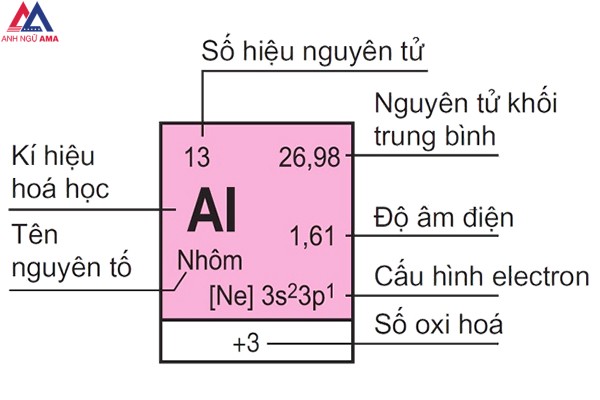
(adsbygoogle = window.adsbygoogle || <>).push();
Tên nguyên tố
Tên nguyên tố thay mặt đại diện cho chất hoá học kia ở dạng tinh khiết, bao gồm 1 kiểu nguyên tử, được khác nhau bởi số hiệu nguyên tửKý hiệu hoá học
Ký hiệu hoá học là tên viết tắt của nguyên tố hoá học đó, thường bao hàm từ 1 mang lại 2 vần âm trong bảng vần âm Latinh, trong đó chữ trước tiên viết hoa.Hướng dẫn học tập thuộc bảng tuần hoàn
Học theo cách thức truyền thống
Ở phương pháp này, bạn sẽ nhận biết các thành phần nhân tố theo 7 đầu mục mà chúng tôi vừa liệt kê sinh sống mục trên. Theo đó, từng ngày, bạn nên chia ra học tập từ 3-5 nguyên tố để dễ ghi ghi nhớ hơn. Để dễ dãi hơn cho việc học, bạn nên dán bảng tuần trả ở khắp các khoanh vùng thường xuyên đi qua. Khi đó, bạn có thể nhìn thấy và dễ ợt học thuộc gần như nguyên tố kia trong ngày.Mẹo học tập thuộc bảng tuần hoàn
Vì bảng tuần hoàn những nguyên tố có không ít thông tin phải có một trong những mẹo khiến cho bạn học thuộc bảng tuần hoàn mau lẹ hơn như sau:Mẹo 1: học tập thuộc câu nói giành riêng cho 16 nguyên tố vận động hoá học của kim loại“ bao giờ cần may áo gần cạnh sắt nhớ sang phố hỏi siêu thị Á Phi Âu “ tương ứng lần lượt với những nguyên tố K, Na, Ca, Mg, Al, Zn, Fe, N, S, P, H, Cu, Hg, Ag, Pt, Au. Mẹo 2: học tập thuộc 6 nguyên tố nhóm IA“Lâu ni không lỏng lẻo coi phim” khớp ứng lần lượt với các nguyên tố Li, Na, K, Rb, Cs, Pr
Mẹo 3: bài ca hoá trịĐây là một trong những bài ca được mách nhau nhau từ lâu lăm để giúp các bạn học ở trong số hoá trị của từng nguyên tố.

Bảng tuần hoàn những nguyên tố hóa học tiếng Anh
Bảng tuần hoàn (tên khá đầy đủ là Bảng tuần hoàn những nguyên tố hóa học, còn được biết thêm với thương hiệu Bảng tuần trả Mendeleev, bảng hóa trị), là một phương thức liệt kê những nguyên tố hóa học thành dạng bảng, dựa vào số liệu nguyên tử (số proton trong hạt nhân), cấu hình electron với các tính chất hóa học tuần trả của chúng.
Dmitri Ivanovich Mendeleev thường được xem là người công bố bảng tuần trả phổ biến đầu tiên vào năm 1869. Ông đã cách tân và phát triển bảng tuần hoàn của chính bản thân mình để minh họa các xu thế tuần trả trong trực thuộc tính các nguyên tố vẫn biết khi đó.
Mendeleev cũng tiên đoán một số trong những thuộc tính của những nguyên tố không biết mà ông hi vọng sẽ tủ vào những chỗ trống vào bảng này. Hầu như những tiên đoán của ông tỏ ra đúng chuẩn khi những nguyên tố kia lần lượt được phân phát hiện. Bảng tuần hoàn của Mendeleev từ này đã được mở rộng và hiệu chỉnh với việc khám giá bán hoặc tổng thích hợp thêm mọi nguyên tố new và sự trở nên tân tiến của các mô hình triết lý để giải thích thuộc tính hóa học.
Các nhân tố được màn biểu diễn theo trơ thổ địa tự số hiệu nguyên tử tăng dần, thường liệt kê thuộc với ký hiệu hóa học trong những ô. Dạng tiêu chuẩn chỉnh của bảng gồm những nguyên tố được thu xếp thành 18 cột và 7 dòng, cùng với hai loại kép ở riêng nằm bên dưới cùng.
Bảng tuần hoàn các nguyên tố hóa học
Nội dung chính
1. Bắt đầu bảng tuần hoàn các nguyên tố hóa học
Bảng tuần hoàn chất hóa học được phát minh bởi Dimitri Mendeleev và được thiết kế ra sử dụng rộng rãi lần trước tiên vào năm 1869. Từ kia trở về sau, bảng tuần hoàn này được công chúng chào đón và vươn lên là một tài liệu đặc trưng cho các công trình khoa học.
Nhờ vào bảng tuần hoàn hóa học này, con fan ngày nay có thể dễ dàng hiểu về sự vận hành của những nguyên tố và những quy pháp luật khác trong khoa học. Bảng tuần hoàn chất hóa học được áp dụng trong thời điểm bây giờ đã được chỉnh sửa và mở rộng thêm vì sự phân phát hiện những nguyên tố new khác. Tuy nhiên, về mặt hình thức thì bảng tuần hoàn các nguyên tố hóa học lúc này vẫn giữ lại được đúng đầy đủ nét cơ bản của bảng tuần hoàn gốc của Mendeleev.
2. Nguyên tắc bố trí bảng hóa trị
Các thành phần trong bảng tuần trả được xếp theo chiều tăng mạnh của năng lượng điện hạt nhân (từ trái sang trọng phải, từ bên trên xuống dưới)Các nguyên tố gồm cùng số lớp e xếp vào và một hàng (chu kì).Các nguyên tố có cấu hình e tương tự nhau được xếp vào cùng một cột (nhóm).3. Kết cấu bảng tuần trả nguyên tố hóa học
3.1 Ô nguyên tố
Mỗi yếu tắc hóa học chỉ chiếm một ô trong bảng tuần hoàn được call là ô nguyên tố.Số thiết bị tự ô nguyên tố = số hiệu nguyên tử của yếu tắc (= số e = số p. = số đơn vị điện tích hạt nhân).

3.2 Chu kì
Chu kì là dãy những nguyên tố mà nguyên tử của chúng có cùng số lớp e, được xếp theo chiều tăng mạnh của điện tích hạt nhân.Số thứ tự chu kì = số lớp e.Bảng tuần hoàn hiện bao gồm 7 chu kì được đánh số từ một đến 7:
Chu kì 1, 2, 3: chu kì nhỏ.
Chu kì 4, 5, 6, 7: chu kì lớn.
Chu kì 7 không hoàn thành.
Trong đó:
Chu kì 1: bao gồm 2 nguyên tố là Hidro ( Z=1) với Heli (Z=2)Chu kì 2: gồm 8 thành phần từ Liti (Z=3) đến Neon (Z=10).Chu kì 3:có 8 nhân tố từ Natri (Z=11) mang đến Argon (Z=18)Chu kì 4:có 18 nhân tố từ Kali (Z=19) mang đến Krypton (Z=36)Chu kì 5: gồm 18 nguyên tố từ Rubidi (Z=37) cho Xenon (Z=54)Chu kì 6: tất cả 32 yếu tố từ Xesi (Z=55) mang lại Ranon (Z=86)Chu kì 7: bước đầu từ thành phần Franxi (Z=87) mang lại nguyên tố Z=1103.3 nhóm nguyên tố bảng hóa trị
Nhóm nguyên tố là tập hợp các nguyên tố nhưng nguyên tử có thông số kỹ thuật e tương tự như nhau cho nên vì thế có đặc thù hóa học tương tự nhau và được xếp thành 1 cột. Bảng tuần hoàn chất hóa học được phân thành 8 nhóm A với 8 team B (riêng nhóm VIIIB có 3 cột).
Nhóm A: bao gồm các nhân tố s và phường Số trang bị tự đội A = tổng thể e lớp bên ngoài cùngNhóm B: bao hàm các yếu tố d với f có cấu hình e nguyên tử thì tận thuộc ở dạng (n – 1)dxnsy:Nếu (x + y) = 3 → 7 thì yếu tố thuộc đội (x + y)B.Nếu (x + y) = 8 → 10 thì nguyên tố thuộc đội VIIIB.Nếu (x + y) > 10 thì yếu tắc thuộc team (x + y – 10)B.
Xem thêm: Công Thức Dùng Mặt Nạ Mướp Đắng Sữa Tươi, Đắp Mặt Nạ Khổ Qua Có Tốt Không
Các thành phần s, p, d, f vào bảng tuần trả nguyên tố hóa học:
Nguyên tố s: bao gồm những nguyên tố đội IA cùng IIA.
Các nguyên tử thành phần s sẽ có electron ở đầu cuối được điền vào phân đội s.
Nguyên tố p: bao hàm những nguyên tố team IIIA cho nhóm VIIIA ( loại bỏ Heli). Electron cuối cùng của nguyên tử nguyên tố p. Sẽ được phân bổ vào phân nhóm p.
Nguyên tố d: là những nguyên tố thuộc nhóm B tất cả electron ở đầu cuối được điền vào phân nhóm d.
Nguyên tố f: là các nguyên tố thuộc họ Lantan với Actini.
Tương tự như những nguyên tố trên, yếu tố f có electron ở đầu cuối được điền vào phân nhóm f.
3.4 Khối nguyên tố (block)
Các nhân tố trong bảng tuần trả thuộc 4 khối: khối s, khối p, khối d cùng khối f.e cuối cùng điền vào phân lớp làm sao (theo thứ tự nấc năng lượng) thì nguyên tố ở trong khối đóĐặc biệt nguyên tố H hiện nay được xếp ở hai địa chỉ là team IA và VIIA phần nhiều ở chu kì I. Nguyên tố He tuy nhiên có 2e phần bên ngoài cùng nhưng được xếp ở nhóm VIIIA. Điều này trả toàn tương xứng vì H giống kim loại kiềm đều sở hữu 1e ở phần bên ngoài cùng tuy vậy nó cũng giống các halogen vì chỉ thiếu hụt 1e nữa là đạt thông số kỹ thuật bền như thể khí hãn hữu He; còn He tuy vậy có 2e ở lớp ngoài cùng mà lại giống những khí hiếm khác là thông số kỹ thuật e sẽ là bão hoà.
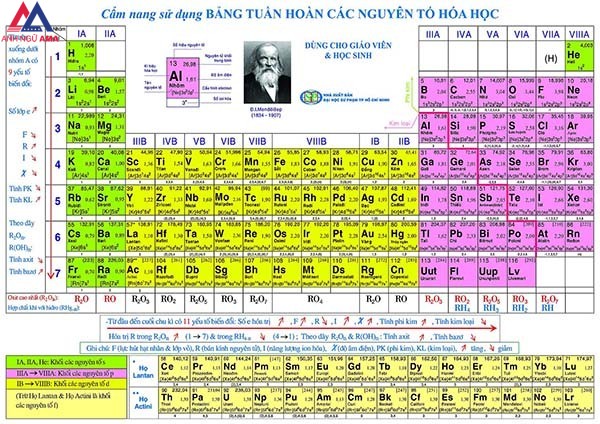
4. Sự chuyển đổi tính hóa học của yếu tắc trong bảng khối hệ thống tuần hoàn những nguyên tố hóa học
Sự thay đổi tính chất của thành phần trong bảng khối hệ thống tuần hoàn các nguyên tố hóa học
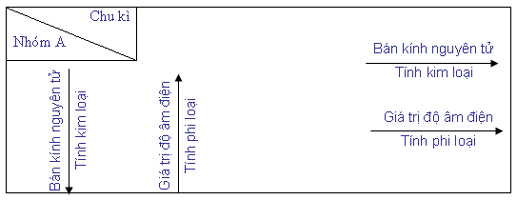
4.1 trong một chu kì
Trong một chu kì theo chiều tăng đột biến của điện tích hạt nhân, có nghĩa là từ đầu cho cuối chu kì
Số electron ngoài cùng của nguyên tử các nguyên tố tăng dần từ 1 đến 8( trừ chu kì 1).
Tính kim loại của các nguyên tố yếu đuối dần, cầm vào kia tính phi kim sẽ mạnh mẽ dần.
4.2 Trong và một nhóm
Khi theo chiều tăng dần đều của năng lượng điện hạt hiền lành trên xuống dướiSố lớp electron của nguyên tử tăng dần
Các nguyên tố sẽ sở hữu tính sắt kẽm kim loại tăng dần, tính phi kim yếu ớt dần
5. Ý nghĩa của bảng tuần hoàn các nguyên tố hóa học
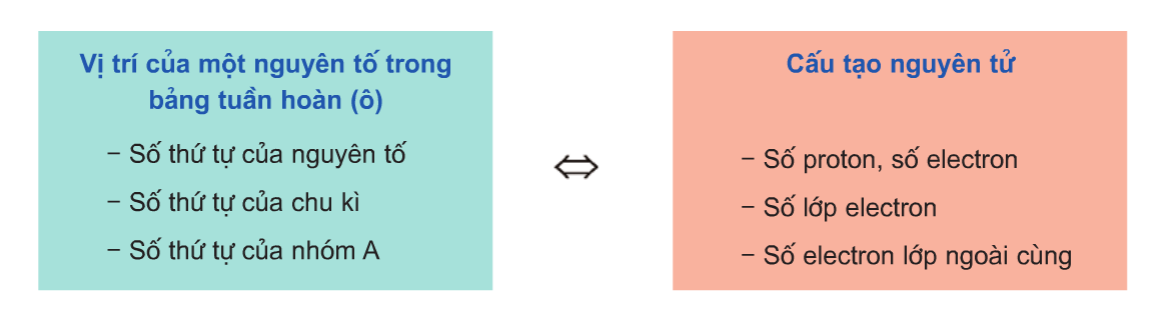
Quan hệ giữa địa chỉ và cấu tạo nguyên tử: lúc biết được địa chỉ của yếu tắc trong bảng tuần trả hóa học, ta có thể suy ra cấu trúc nguyên tử của yếu tắc đó và ngược lại.
Quan hệ giữa vị trí và đặc điểm của nguyên tố: lúc biết được địa chỉ của yếu tắc trong bảng khối hệ thống tuần hoàn những nguyên tố hóa học, ta hoàn toàn có thể suy ra những tính chất hóa học cơ bản của thành phần đó.
So sánh đặc thù hóa học của một yếu tắc với các nguyên tố lân cận nó: phụ thuộc quy luật biến hóa tính chất trong một chu kì hay là 1 nhóm nguyên tố rất có thể so sánh tính chất hóa học tập của nguyên tố đó với những nguyên tố lạm cận.
Bảng tuần hoàn các nguyên tố chất hóa học được xem là cơ phiên bản để có thể phát triển lên các kiến thức sâu xa hơn. Trải qua việc chia sẻ cấu tạo, những nguyên tắc tương tự như quy phương tiện của bảng tuần hoàn chất hóa học trên phía trên đã giúp cho bạn thêm phần nào nắm vững và vận dụng xuất sắc hơn vào bài tập.
6. Một trong những cách ghi ghi nhớ bảng tuần hoàn hiệu quả
1. Nghiên cứu chi tiết các phía bên trong bảng yếu tố hóa học
Đây là một trong cách học tập ngấm dần với giúp cho bạn nhớ lâu các thông tin bằng cách lần lượt học những thành phần của một yếu tắc trong bảng. Bạn cũng có thể sắp xếp một ngày học tập từ 5 đến 10 nguyên tố, dần dần dần bạn sẽ học hết tất cả các nguyên tố gồm trong bảng.
2. Làm cho nhiều các bài tập tương quan
Để rất có thể thường xuyên chú ý thấy các thông tin về các nguyên tố vào bảng, chúng ta có thể in bảng tuần hoàn các nguyên tố chất hóa học ra và dán tại một nơi mà chúng ta thường lui tới.
3. Phân tách nhóm cùng sử dụng những mẹo ghi lưu giữ nhanh
Trong trường hợp nếu mà bạn buộc phải hoặc ước muốn phải ghi ghi nhớ gấp những thông tin về bảng tuần hoàn, các chúng ta có thể chia nhỏ các thành phần thành các nhóm với đặt tên những nguyên tố đó thành những cụm làm thế nào cho dễ nhớ nhất, sau đó học ở trong lòng. Nếu các bạn sợ tốn thời gian, các chúng ta cũng có thể tham khảo các cách thu xếp hiện có trên mạng mạng internet như:
Nhóm IA: nhì (H), Li (Li), nào (Na), ko (K), Rót (Rb), Cà (Cs), Fê (Fr).
Nhóm IIA: Banh (Be), miệng (Mg), Cá (Ca), Sấu (Sr), Bẻ (Ba), Răng (Ra).
Nhóm IIIA: tía (B), Ai (Al), Gáy (Ga), inch (In), Tai (Ti).
Nhóm IV: Chú (C), Sỉ (Si), call em (Ge), sang nhắm (Sn), Phở bò (Pb).
Nhóm V: đơn vị (N), Phương (P), Ăn (As), sinh sống (Sb), túng thiếu (Bi).
Nhóm VI: Ông (O), Say (S), Sỉn (Se), té (Te), Pò (Po).
Nhóm VII: đề nghị (F), đưa ra (Cl), nhỏ xíu (Br), yêu (I), Anh (At).
Nhóm VIII: Hằng (He), Nga (Ne), Ăn (Ar), Khúc (Kr), Xương (Xe), dragon (Rn).
Với những tin tức mà chúng tôi share ở trên, hi vọng rằng các bạn sẽ có thể vậy rõ những kiến thức quan trọng liên quan mang đến bảng tuần hoàn những nguyên tố hóa học.














